Lista tematów:
Fizyka kurs podstawowy LO
Podstawa fizyki w klasie pierwszej LO
Temat: Budowa jądra atomowego

Budowa jądra atomowego
Gęstość materii w atomie
 Im bliżej środka tym większe prawdopodobieństwo napotkania materii. W samym środku atomu gromadzi się prawie cała masa atomu. Środek ten nazywamy jądrem atomowym.
Im bliżej środka tym większe prawdopodobieństwo napotkania materii. W samym środku atomu gromadzi się prawie cała masa atomu. Środek ten nazywamy jądrem atomowym.
Samo jądro również nie jest jednorodne i jego gęstość w różnych miejscach jest różna, co świadczy o tym, że składa się z mniejszych części.
Cząstki tworzące atom
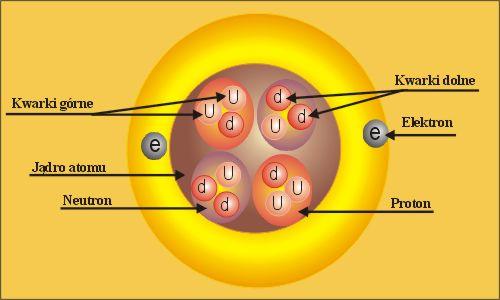 We wnętrzu jądra znajdują się protony, które mają ładunek elementarny dodatni oraz neutrony, które nie mają ładunku. Na zewnątrz jądra krążą elektrony o ładunku ujemnym, ale o wartości identycznej co proton. Protony i neutrony składają się z mniejszych cząstek nazywanych kwarkami.
We wnętrzu jądra znajdują się protony, które mają ładunek elementarny dodatni oraz neutrony, które nie mają ładunku. Na zewnątrz jądra krążą elektrony o ładunku ujemnym, ale o wartości identycznej co proton. Protony i neutrony składają się z mniejszych cząstek nazywanych kwarkami.
Masa protonu i neutronu jest zbliżona podczas gdy elektron jest ponad 1800 razy lżejszy od każdego z nich.
Ładunek atomu, jony
Normalny atom zawiera tyle samo protonów co krążących na orbitach elektronów. Jest więc elektrycznie obojętny (elektron i proton mają identyczną wartość ładunku ale o przeciwnym znaku).
 Atom może przyłączyć elektron (lub elektrony) staje się wtedy jonem ujemnym. Może też utracić elektron (lub elektrony) stając się jonem dodatnim. ładunek jonu jest zawsze wielokrotnością ładunku elementarnego.
Atom może przyłączyć elektron (lub elektrony) staje się wtedy jonem ujemnym. Może też utracić elektron (lub elektrony) stając się jonem dodatnim. ładunek jonu jest zawsze wielokrotnością ładunku elementarnego.
Siły jądrowe
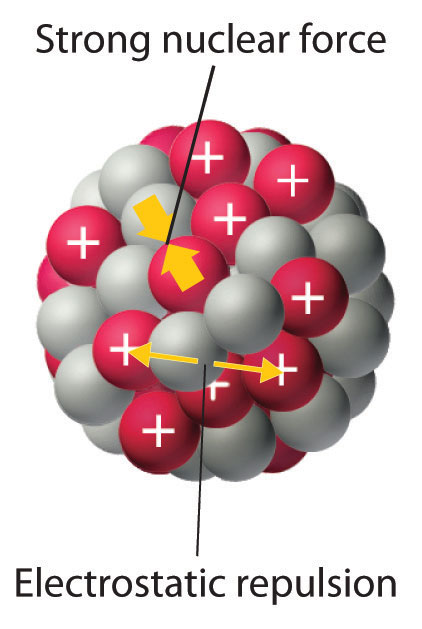 Wszystkie nukleony przyciągają się wzajemnie. Siła ta zależy od rodzaju oddziałujących nukleonów: proton-proton, neutron-neutron, proton-neutron. Nukleony na obrzeżach zewnątrz są ciągnięte tylko do środka jądra, natomiast protony dodatkowo odpychają się siłami elektrostatycznymi. Siły jądrowe są wynikiem oddziaływań między kwarkami, z których to składają się protony i neutrony. Jednak siły te działają tylko w bardzo małych odległościach (są odwrotnie proporcjonalne do czwartej potęgi odległości). Natomiast siły elektryczne odpychania protonów mają większy zasięg są odwrotnie proporcjonalne do czwartej potęgi odległości). Z tego powodu trwałe atomy nie mogą być zbyt duże, a cięższe atomy muszą mieć więcej neutronów niż protonów.
Wszystkie nukleony przyciągają się wzajemnie. Siła ta zależy od rodzaju oddziałujących nukleonów: proton-proton, neutron-neutron, proton-neutron. Nukleony na obrzeżach zewnątrz są ciągnięte tylko do środka jądra, natomiast protony dodatkowo odpychają się siłami elektrostatycznymi. Siły jądrowe są wynikiem oddziaływań między kwarkami, z których to składają się protony i neutrony. Jednak siły te działają tylko w bardzo małych odległościach (są odwrotnie proporcjonalne do czwartej potęgi odległości). Natomiast siły elektryczne odpychania protonów mają większy zasięg są odwrotnie proporcjonalne do czwartej potęgi odległości). Z tego powodu trwałe atomy nie mogą być zbyt duże, a cięższe atomy muszą mieć więcej neutronów niż protonów.
Liczba atomowa i masowa
- symboliczny zapis pierwiastka, gdzie:
X - symbol chemiczny pierwiastka
A - liczba masowa - określa ilość nukleonów w jądrze atomu
Z - liczba atomowa - określa ilość protonów w jądrze i decyduje o tym jaki to pierwiastek (może być pominięta w zapisie bo można wywnioskować jej wartość z symbolu)
N = A - Z - liczba neutronów jest różnicą między liczbą masową, a atomową
Izotopy, izobary i izotony
Izotopy to atomy tego samego pierwiastka różniące się liczbą masową, a więc mające tyle samo protonów, ale różną ilość neutronów. Mają też różną masę. Najbardziej znany przykład to izotopy wodoru:
protonium: \({}^{1}_1 H\) deuter: \({}^{2}_1 D\) i tryt: \({}^{3}_1 T\)
Izobary to atomy różnych pierwiastków (różna ilość protonów), ale mającą tę samą liczbę masową (czyli ilość nukleonów) np. \({}^{14}_7 N \) i \({}^{14}_8 O\)
Izotony to atomy różnych pierwiastków ale mający tę samą liczbę neutronów (różnią się wiec i liczbę masową i atomową, a ich różnica jest taka sama) np.\({}^{12}_6 C\) i \({}^{13}_7 N\)
Jednostka unit. Masa atomowa
Jednostką masy atomowej jest unit. Jest to 1/12 masy izotopu
1 u = 1,66·10-27kg
Masa atomowa to średni ciężar danego pierwiastka wyrażony w unitach. Ponieważ w przyrodzie każdy pierwiastek występuje w różnych odmianach (różne izotopy) więc na układzie okresowym pierwiastków podaje się średnią zależną od częstotliwości występowania różnych izotopów danego pierwiastka na Ziemi.
Liczba atomowa i masowa
Budowa atomu
poglądowo
Budowa jądra – lekcje zdalne
Jak odkryto atomy – Eureka
