
- Temat: Budowa atomu







Pojęcie atomu wymyślił Demokryt z Abbery, starożytny filozof. Głosił on, że materię można mechanicznie kruszyć na mniejsze części aż do uzyskania małych kulek, które są już niepodzielne (takie w przybliżeniu jest znaczenie słowa atom w języku greckim).
Mimo, że wielu uczonych wierzyło w hipotezę Demokryta (np. Newton) to dowodów na istnienie atomu dostarczyli chemicy odkrywając, że substancje łączą się w związki chemiczne w ściśle określonych proporcjach co łatwo wyjaśnić istnieniem pierwiastków chemicznych.
Dzisiaj możemy już zobaczyć atom dzięki mikroskopowi elektronowemu.
Botanik Robert Brown badając pyłki traw pod mikroskopem w wodzie zauważył, że wykonują one dziwne ruchy. Ruch ich był chaotyczny, ale można było dostrzec chwile ruchu prostoliniowego. Brown nie potrafił wyjaśnić przyczyn ruchu. Pierwszy wyjaśnienie tego zjawiska podał Albert Einstein.
 Zgodnie z tym wyjaśnieniem pyłki poruszały się pod wpływem ruchu chaotycznego cząsteczek wody (związanego z temperaturą). Cząstki wody w swym ruchu bombardowały pyłki powodując ich przemieszczanie. Był to pośredni dowód istnienia cząsteczek i atomów.
Zgodnie z tym wyjaśnieniem pyłki poruszały się pod wpływem ruchu chaotycznego cząsteczek wody (związanego z temperaturą). Cząstki wody w swym ruchu bombardowały pyłki powodując ich przemieszczanie. Był to pośredni dowód istnienia cząsteczek i atomów.
Odkrywca elektronu J.J.Thomson udowodnił, że elektrony są częścią atomu. Ponieważ elektrony mogą opuścić atom więc nie jest on niepodzielny i jednolity. Thomson zaproponował model "ciasteczkowy atomu".
 Według tego modelu atom przypomina ciasteczko, naładowane dodatnio i umieszczone w nim ujemne rodzynki czyli elektrony. Była to pierwsza próba wyjaśnienia budowy atomu.
Według tego modelu atom przypomina ciasteczko, naładowane dodatnio i umieszczone w nim ujemne rodzynki czyli elektrony. Była to pierwsza próba wyjaśnienia budowy atomu.
 Aby zweryfikować poprawność modelu Thomsona jego dawny uczeń Ernest Rutheford postanowił przeprowadzić eksperyment, w którym bombardował jadra atomu złota (w złotej foli) za pomocą promieniowania jądrowego w postaci cząstek alfa (jądra helu).
Aby zweryfikować poprawność modelu Thomsona jego dawny uczeń Ernest Rutheford postanowił przeprowadzić eksperyment, w którym bombardował jadra atomu złota (w złotej foli) za pomocą promieniowania jądrowego w postaci cząstek alfa (jądra helu).
Rutheford spodziewał się, że małe, ale ciężkie o dużej energii cząstki alfa, przejdą bez większego odchylenia przez duży w porównaniu do tych cząstek atom. Jednak okazało się, że większość przelatywała przez atom bez reakcji natomiast niektóre były bardzo mocno odchylane jakby uderzały o coś ciężkiego i gęstego. W taki sposób odkrył istnienie jądra atomowego.
 Rutheford udowodnił, że większość masy i ładunek dodatni znajduje się w jądrze atomowym, a elektrony znajdują się wokół niego.
Rutheford udowodnił, że większość masy i ładunek dodatni znajduje się w jądrze atomowym, a elektrony znajdują się wokół niego.
Bohr w swoim modelu wyjaśnił, że elektrony (są ujemne) krążą na orbitach elektronowych wokół dodatnio naładowanego jądra.
Jądra składają się z protonów naładowanych dodatnio i neutronów bez ładunku. Protony i neutrony mają zbliżoną masę i są około 1800 razy cięższe od elektronów. Ale ładunek elektryczny protonu i elektronu jest identyczny co do wartości.
 Atom w rzeczywistości jest chmurą prawdopodobieństwa znalezienia materii (to znaczy, że nie da się określić gdzie konkretnie znajduje się cząstka elementarna). Na zewnątrz są powłoki elektronowe, w środku ciężkie jądro. Prawie cała materia atomu znajduje się w jądrze. A jądro ma średnicę 100000 razy mniejszą od atomu.
Atom w rzeczywistości jest chmurą prawdopodobieństwa znalezienia materii (to znaczy, że nie da się określić gdzie konkretnie znajduje się cząstka elementarna). Na zewnątrz są powłoki elektronowe, w środku ciężkie jądro. Prawie cała materia atomu znajduje się w jądrze. A jądro ma średnicę 100000 razy mniejszą od atomu.
 Według tego modelu elektrony przyciągane siłą elektryczną jądra krążą wokół niego. Energia elektronów jest sumą energii kinetycznej w ruchu po okręgu i energii potencjalnej przyciągania jądra. Gdy elektrony zmieniają orbity to zmienia się również ich energia.
Według tego modelu elektrony przyciągane siłą elektryczną jądra krążą wokół niego. Energia elektronów jest sumą energii kinetycznej w ruchu po okręgu i energii potencjalnej przyciągania jądra. Gdy elektrony zmieniają orbity to zmienia się również ich energia.
Elektrony według tego modelu nie mogą znajdować się na dowolnych orbitach w dowolnej odległości od jądra tylko muszą przyjmować jedną z dopuszczalnych orbit. Ich energia jest zatem skwantowana (mogą przyjmować tylko określone porcje energii).
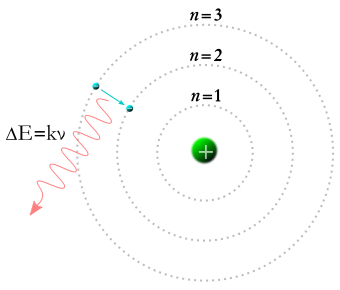 Najniższa orbita jaką może przyjąć elektron w atomie ma największą ujemną wartość energii. (Elektron jak w studni musi być wyciągnięty na zewnątrz do czego potrzeba energii). Mówimy, że atom jest w stanie podstawowym gdy elektrony przebywają na najniższych możliwych orbitach.
Najniższa orbita jaką może przyjąć elektron w atomie ma największą ujemną wartość energii. (Elektron jak w studni musi być wyciągnięty na zewnątrz do czego potrzeba energii). Mówimy, że atom jest w stanie podstawowym gdy elektrony przebywają na najniższych możliwych orbitach.
Gdy elektrony znajdą się wyżej i zwolnią część niższych orbit mówimy o stanie wzbudzonym.
Elektron przeskakując między orbitami pobiera lub oddaje energię, najczęściej w postaci promieniowania.


Aby elektron mógł przeskoczyć na wyższą orbitę musi otrzymać energię, co więcej energia ta musi być dokładnie równa różnicy energii elektronu na orbicie początkowej i docelowej. Gdy będzie ona za mała lub za duża elektron nie przyjmie jej. Jeżeli elektron spada na niższą orbitę to oddaje nadmiar energii. Najczęściej wiąże się to z pochłanianiem i wypromieniowaniem fal elektromagnetycznych.
 Ciała świecą wtedy gdy dostarczamy im energii. Może to być spowodowane zderzeniami atomów przy drganiach termicznych, albo dostarczeniu energii poprzez prąd. Również procesy chemiczne mogą wywoływać świecenie. Elektrony przejmują energię (np. zderzeń) i wykorzystują ją do przeskoczenia na wyższą orbitę. Po czym następuje emisja spontaniczna, czyli samodzielny, niewymuszony przeskok elektronu niżej. Różnica energii między poziomami zostaje wypromieniowana. Dlatego w promieniowaniu ciała pojawiają się charakterystyczne linie widmowe odpowiadające różnicom energii między poziomami energetycznymi elektronów na orbitach.
Ciała świecą wtedy gdy dostarczamy im energii. Może to być spowodowane zderzeniami atomów przy drganiach termicznych, albo dostarczeniu energii poprzez prąd. Również procesy chemiczne mogą wywoływać świecenie. Elektrony przejmują energię (np. zderzeń) i wykorzystują ją do przeskoczenia na wyższą orbitę. Po czym następuje emisja spontaniczna, czyli samodzielny, niewymuszony przeskok elektronu niżej. Różnica energii między poziomami zostaje wypromieniowana. Dlatego w promieniowaniu ciała pojawiają się charakterystyczne linie widmowe odpowiadające różnicom energii między poziomami energetycznymi elektronów na orbitach.
/